电解质溶液热力学模型概述
当一定量的无机盐或离子型液体溶解到水或其他溶剂(如乙醇、苯等有机溶剂)中时,其可解离为阴离子和阳离子,从而形成电解质溶液,此时阴阳离子、离子对及溶剂分子共存。电解质溶液无论是在日常生活中还是在工业生产中比比皆是。如人们日常所消耗的钠盐,如将其溶解于水中,则可形成钠盐水溶液;工业上氨、纯碱以及盐酸等生产中,无不涉及到电解质溶液。
根据溶质解离程度的不同,通常可将电解质溶液分为弱电解质和强电解质。在强电解质溶液中,溶质仅以正负离子的形式存在,如在NaCl水溶液中,NaCl分子可完全解离从而以钠离子和氯离子的形式与水分子共存;而在弱电解质溶液中,溶质不仅以正负离子的形式存在,还有部分以分子的形式溶解在溶剂中,此时溶液中正负离子和溶质分子的数量由溶质解离平衡常数来确定,如一些弱酸(如H2CO3, HAc等)和弱碱(如Ca(OH)2, 氨水等)。 Robinson和Stoke将弱电解质溶液称为‘缔合’溶液,即正负或阴阳离子间以共价体的形式存在而维系体系的平衡;而相应的强电解质溶液则称为‘非缔合’溶液,即溶液中正负或阴阳离子独自存在。对于弱电解质,Bjerrum曾提出用‘离子对电解质’溶液来表征,认为在此溶液中正负离子之间通过静电吸引而相互缔合。然而,从严格意义上来说,对强和弱电解质(或非缔合和缔合)溶液的分类原则上仅适用于常温常压下。实际上,随着体系温度的升高,由于水介电常数的减小在水溶液中总是有离子对存在的,同时离子对的形成与溶质本身也有一定的关联,但这种关联随着离子电量的升高而减弱,Cummings等人曾借助分子动力学方法较为详细的研究了NaCl在近临界和超临界水溶液中正负离子的缔合机理。
由于电解质溶液自身的复杂性以及其在实际工业中的广泛应用,在实验和理论方面的研究均引起了广大科研工作者的兴趣。目前文献已积累了较多常温常压下电解质溶液的热力学数据,但高温高压下的实验数据还较少。在理论方面较常规流体也具有更多的挑战性,如如何考虑溶质的电离、溶质离子和溶剂分子的相互作用、极性以及离子间的缔合等。目前,用于电解质溶液研究的理论方法主要有经典电解质溶液热力学理论如Debye-Hückel理论、 Pitzer模型、积分方程方法及微扰理论等。随着统计缔合流体理论的提出和发展,近二十年来应用统计缔合流体理论(SAFT)描述电解质溶液热力学行为也获得了越来越多的关注。对于电解质溶液热力学基础知识和理论的详细介绍可参阅胡英院士专著以及李以圭和陆九芳教授的论著,也可参考国外相关电解质溶液理论方面的专著。
一 经典电解质溶液热力学理论及模型
自Arrhenius认为盐完全解离在对应的溶液中并提出第一个电解质溶液理论模型以来,最具影响力的工作之一应属于Debye和Hückel提出的理论,简称为D-H理论。在此理论中,认为溶质在溶剂中完全解离,溶质离子以点电荷的形式存在,而溶剂被看为具有一定介电常数的连续介质。在溶液中,离子间的静电作用通过求解线性Poisson-Boltzmann方程获得,且忽略离子极化。为有效描述离子溶液性质,还提出了离子强度及离子氛厚度等基本概念,此概念一直沿用至今。D-H理论可以精确的描述出单一溶质且浓度较小情况下电解质溶液热力学性质,如溶质的平均离子活度、溶剂渗透系数,但当浓度较大时(摩尔质量浓度m>0.001mol·kg-1),由于离子尺寸以及离子极化对溶液性质影响的增强,D-H理论则显得力不从心,但可以通过在D-H理论中引入离子尺寸等其他因素对体系热力学性质的影响从而拓展D-H理论的应用范围。对D-H理论最为典型的修正为在其溶质平均离子活度系数计算式中加入经验修正项,如Guggenheim和Turgeon在D-H理论中加入一线性修正项后,可将D-H理论拓展使用到0.1至1 mol·kg-1浓度范围。之后,Bromley认为在Guggenheim和Turgeon模型中的相互作用参数应与溶质的离子强度呈线性关系,对D-H模型进行了进一步的修正。Bromley的模型可应用至6 mol·kg-1。在对D-H理论修改中,Meissner等提出对比活度系数的概念并发现此值和离子强度具有一定的普遍化关联,为方便计算还提出了一系列普遍化计算关系式,从而大大增强了D-H理论在实际电解质溶液中的应用能力。Pizter等人将离子处理为带电硬球,将D-H理论中的Boltzmnn方程展开为三项,并引入维里展开及纳入非静电相互作用,提出了著名的Pizter模型(也可称为D-H3理论)。Sadowski及其同事还将D-H理论与微扰理论相结合,对强弱电解质水溶液的应用都取得了良好的效果。
2 离子水化理论
在D-H理论及相关修正模型中,溶剂均被看作具有一介电系数的连续性介质,溶质离子在其中可自由运动,此假设在溶质浓度较小时是合理。但随着溶质浓度的增加,溶质离子和溶剂分子之间的相互作用增强,从而导致了通过D-H理论获得的离子活度对实际离子活度系数产生了偏离。为解决此现象,Stokes和Robinson提出了离子水化理论,认为溶液中一部分溶剂分子通过一定的作用方式可与溶质离子相结合,形成溶剂化离子,而其他未与离子结合的溶剂分子则为自由分子,其模型如图1所示。当溶液很稀世,几乎所有的溶剂分子都是自由的(如DH理论),而随着溶质浓度的增加,溶液中自由溶剂分子逐渐减少。经实际应用表明,对大多数1:1型电解质水溶液,可适用至5至6 mol·kg-1的浓度范围;对其他如2:1型电解质水溶液也可至1 mol·kg-1。研究表明,对于各种电解质水溶液,离子的碰撞直径都在0.35至0.62纳米间,且对于具有共同负离子的电解质,正离子的水化数(1mol离子结合的溶剂分子的量)随着离子尺寸的增加而减弱,即离子愈小,电场愈强,水化数愈大,与预期结果相同;但对于具有相同正离子的电解质,其负离子的水化数则随离子尺寸增大而增强,与预期结果相反。为了更好的描述高浓度下电解质溶液性质,Stokes和Robinson还进一步提出了逐级水化理论,认为离子可以和溶剂分子逐级形成水化族团,此水化强度随着溶质浓度的增加而逐级减弱,因为当溶质浓度升高时,溶液中自由溶剂分子浓度减少了。如在逐级水化模型中引入四个可调参数,对LiCl水溶液,可将模型拓展至20 mol·kg-1。

图 1. Stokes-Robinson水化离子示意图
虽然离子水化理论取得了相当的成功,但是其仍然建立在D-H理论完全正确基础之上。然而,D-H理论将电解质溶液的非理想性完全归结于离子间的相互作用,此在稀溶液条件下是合适的,但是随着溶质浓度的升高,仅用介电常数来表征离子与溶剂以及溶剂之间的相互作用已不能反映复杂的实际情况;此外,在D-H理论中对Boltzmann方程的Tayler级数展开中仅取了前两项,这些问题的提出为进一步完善电解质溶液理论研究提供了依据。
3 离子缔合理论
在以上的D-H理论及离子水化理论中,均未考虑离子间的缔合作用,认为溶质完全解离在具有一介电常数的溶剂中。然而,即使是强电解质,在具低的介电常数溶剂中也存在离子缔合作用;此外离子缔合现象在混合溶剂或高温条件下会变得相当重要,此均已由相关实验方法及计算机模拟所证实。因此在对电解质溶液进行研究时还需考虑离子的缔合问题。

表 1. 不同类型电解质Bjerrum特征距离
Bjerrum认为:在电解质溶液中,带有相反电荷的正负离子可以通过库仑力作用相互吸引而形成一起协同运动的离子对,其与分子的区别在于分子是由化学键形成。在理论推导中,Bjerrum引入一特征距离参数q,当正负离子间距离小于这一特征量时,它们形成离子对;当离子间距离大于此特征距离时,正负离子为自由体。此特征量可表示为:
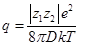 (1)
(1)
这里,zi为正负离子电荷数,e为基本单位电量,D=D0Dr为溶剂介电常数,和分别为真空和对比介电常数,k和T分别为boltzmann常数和系统温度。对于25℃条件下的水溶液,各种类型电解质溶质对应的特征距离参数q如表1所示,特征距离随离子电量的增加而增加。然而,在实际溶液中,自由离子转变为离子对是一渐变过程,而Bjerrum则将其规定为定值,因此在理论是存在一定缺陷的。针对Bjerrum理论的不足,Fuoss以及Lee和Wheaton对缔合理论又做了进一步的修改和完善,在此修改的离子缔合理论中,除了有Bjerrum认为的接触型离子对的存在,还包含溶剂分子分开的离子对。
二 积分方程理论
除经典的理论模型外,基于统计力学的积分方程方法同样被应用于研究电解质溶液热力学行为,此方法可方便的考虑离子尺寸对体系性质的影响和获得离子的结构信息。积分方程方法一般从Ornstein-Zernike方程展开,采用如超网链HNC、PY以及平均球MSA等不同的近似方法,从而获得最终的分析或解析表达式,具体解法和讨论可参加李以圭和陆九芳专著。在这几种方法中,由于平均球近似(MSA)方法可以提供精确的原始模型(溶剂为具有一介电常数的连续介质)分析解,因此已被广泛的应用于电解质溶液中。
基于MSA方法的电解质溶液理论,总体上可分为原始模型和非原始模型。在原始模型中,和D-H及其他经典理论相似,溶剂溶剂仍然作用具有一介电常数的连续介质,只为溶剂提供运动空间,而离子则被看为由带电硬球组成;在非原始模型,电解质溶液则被看着为由溶剂分子和溶剂离子共同构成的混合物。在对溶质离子的具体处理中,可设正负离子具有相同或不同的离子直径,前者对应的为受限模型,而后者为非受限模型。Waisman和Lebowitz假设溶液中的离子为具有一定体积且大小相等的带电硬球,首先提出了受限原始模型(RPM),在MSA框架内获得了一分析解,此方法较D-H理论要更为简单。Blum接着将MSA拓展至离子具有不同尺寸的球型系统中,即为非受限原始模型。Shiah和Tseng应用Blum拓展的MSA方面对具不同离子直径的电解质体系进行了研究,假设阳离子有溶剂化作用,其离子直径随盐浓度的变化而变化,而阴离子具有固定直径,用三个可调参数计算了26种水溶液电解质的蒸气压数据,取得了良好的效果。Planche和Renon认为分子由具有短程排斥作用且不同大小的硬球构成,提出了一个MSA屏蔽参数的简单表达式,并成功计算了浓度达到6 mol·kg-1的电解质溶液渗透系数。Copeman和Stein在MSA基础上,考虑了离子的排斥、吸引和静电作用,用Pauling和估算的Bondi离子直径满意的关联了13种1:1、1:2和2:1强电解质溶液的平均活度系数。Adelman和Deutch则提出一混合体系热力学模型,认为混合物有两个组分组成,其中一个组分为带电硬球,另一个为具有永久偶极硬球。近年来,将基于MSA积分方程近似解和统计缔合流体理论(SAFT)相结合构建新的电解质溶液热力学模型已被广泛的用于电解质溶液热力学性质的研究中。
三 微扰及统计缔合流体理论的应用
微扰理论,即在统计力学框架下将目标系统的Helmholtz自由能围绕参考流体按照Taylor展开方法表示为温度倒数的函数,此方法具有严格的统计力学和分子力学理论基础。自Zwanzig开创性的提出此理论以来,已有多种微扰方法报道发表,如早期的Barker-Henderson、Chandler-Weeks-Anderson以及Gubbins-Gray微扰理论,这些理论推导严格,形式复杂,可用于简单的模型或实际流体,但不便应用于工程实际。为将微扰理论的应用于实际工程,许多研究者又做了很多卓有成效的贡献,如美国科学院院士Prausnitz及同事基于van der Waals普遍化配分函数提出的微扰硬链理论(PHCT);Vimalchand等考虑到分子各向异性相互作用,并结合PHCT方程提出了微扰各向异性硬链理论(PACT);Donohue及同事把缔合概念引入PACT模型开发了缔合微扰各向异性链理论(APACT),这些模型主要侧重于实际应用,因此在公式推导中引入了很多经验近似。在微扰理论中,具有重要影响的理论之一是Weitheim提出的热力学微扰理论(TPT),据此开发的统计缔合流体理论(SAFT)以及其状态方程在工程实际系统中已得到了广泛的应用。
微扰理论在电解质应用方面,Stell和Lebowitz曾在原始模型基础上开发了一微扰方法,在此方法中纳入了离子硬球直径效应;Henderson等则通过求解离子-偶极模型的拓展项获得离子系统微扰项。Jin和Donohue将微扰各向异性链理论(PACT)拓展至电解质系统。在方程中,他们考虑了分子-分子、电荷-电荷、电荷-分子以及溶液中离子-分子之间的相互作用,同时在原始模型基础上引入溶剂的介电常数来修正溶剂化效应,借助一个离子尺寸相关的可调参数模型对包括多盐系统的电解质水溶液均获得了满意的结果。Chan认为排斥项在电解质溶液热力学性质的描述中起着重要作用,因此作者在模型中引入Carnahan-Starling硬球方程表征排斥力贡献,并用Stell和Lebowitz根据RPM开发的微扰项描述离子-离子相互作用,借助实验活度系数拟合得到了离子直径,理论模拟值和实验结果吻合良好,但获得的离子直径和Pauling直径实验数据相差较大。Chan为证明排斥项在模型中的作用,用简单的D-H理论表达式取代了方程中Stell和Lebowitz的六项展开式,研究结果表明通过两种方法可以获得相同的计算精度。Chan还应用Henderson等人的离子-偶极微扰展开式研究了电解质溶液热力学性质,结果发现模型没有获得更高的计算精度,这可能是由于作者只采用了离子-离子相互作用,而Henderson等人的微扰项中则包括了离子-离子、离子-偶极和偶极-偶极等相互作用。
Jackson及同事基于受限的原始模型(RMP)首次将SAFT-VR状态方程拓展至强电解质水溶液,获得了SAFT-VRE模型。此模型中,水被处理为具有氢键缔合和方阱色散作用的硬球,离子为没有色散作用的带电硬球,且阴阳离子具有相同的平均直径,离子-离子间长程库伦力相互作用通过MSA表示,而水-水以及离子-水之间的长程引力由方阱色散描述,作者成功的计算了9种单盐水溶液体系和1组混合盐系统在273-373K温度范围内的蒸气压和密度。SAFT-VRE还可预测出水和烷烃混合物中盐析效应。刘文彬等考虑电解质溶液中存在离子-离子、离子-偶极及偶极-偶极等相互作用,基于原始SAFT方程获得了一电解质溶液热力学模型,此模型可用于模拟1:1、2:1及1:2等类型溶液平均离子活度系数和溶液密度。借助非原始MSA低密度展开理论和SAFT模型,刘志平等开发了一两参数电解质模型,其中考虑了溶剂-溶剂及离子-溶剂之间的相互作用,在此模型中无需溶剂的介电常数经验表达式。刘燕等还将一阶MSA理论和Sutherland 势能相结合开放了一可同时用于一价和二价离子电解质溶液。
Radosz及同事在将SAFT型状态方程拓展至电解质水溶液做了大量工作。他们认为溶质是由不同链节直径的带电球形链节构成,将强电解质水溶液剩余亥氏函数应包括硬球、色散、缔合和静电作用,其中静电作用通过受限原始MSA模型获得,其他贡献则来自于异核链SAFT状态方程,从而获得一新的SAFT型电解质溶液状态方程并将其命名为SAFT1。此模型被成功用于单电解质和多电解质溶液热力学的计算,且在拟合模型参数时,作者发现采用盐的实验平均活度系数和溶液密度比用溶剂渗透系数更有效。此后,为了将SAFT拓展至多价溶质电解质溶液,作者又开发了一新的方阱色散表达式,结合原始MSA模型获得了SAFT2热力学模型。在SAFT2模型中,为了说明压力对溶液性质的影响,在模型中考虑了阴阳离子之间的短程相互作用,体系中色散项包括水-水、水-离子和阴阳离子之间作用力,但不考虑阴离子-阴离子以及阳离子-阳离子之间色散力;静电作用通过RPM模型获得,其中溶剂的介电常数表示为温度和压力的函数,其参数由Fernandez等人数据拟合得到。作者首先根据常温(298.15K)低压下的实验值回归获得水、阴离子、阳离子的四个模型参数,为了研究不同温度下电解质溶液热力学性质,他们将分子参数表示为温度的函数,并通过低压和不同温度下的实验值确定出方程中的参数,以后用这些参数去计算低压和不同温度下以及预测高压下的活度系数、渗透压、溶液密度等,结果良好。结合非原始MSA模型,Zhao等和Herzog等分别又将原始SAFT-VR和PC-SAFT拓展至电解质溶液领域。Cameretti等则借助DH理论来描述静电相互作用,将其亥氏自由能表示为
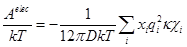 (2)
(2)
其中,
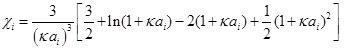 (3)
(3)
从而将PC-SAFT应用于电解质溶液,此模型可用于模拟一价、二价以及三价单盐及多盐电解质溶液热力学性质。此外,引入一化学平衡常数,此模型也可用于弱电解质溶液。
在SWCF-VR基础之上,李进龙等人引入了原始的MSA模型,将用于常规流体的状态方程应用到了电解质水溶液。在该模型中,作者考虑了离子之间的硬球排斥、方阱引力、链节成链、静电效应及离子缔合等作用,对常规电解质溶液和离子液体水溶液的热力学性质模拟中取得了良好的效果(图2和图3),同时还预测了离子缔合常数。
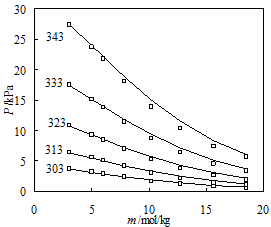
图 2. 不同温度下LiCl水溶液蒸汽压模型预测值(线)和实验值(点)比较
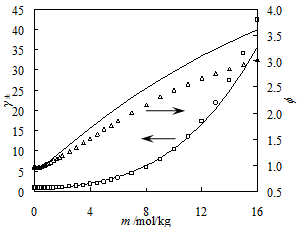
图 3. HCl水溶液高浓度下离子平均活度系数和渗透系数预测值(线)和实验值(点)比较
(三角-渗透系数;方框-平均离子活度系数)
